Avrupa ve Amerika Birleşik Devletleri’nde tanımlanmış vakalarla tekrar gündeme gelen1-3 maymun çiçeği (monkeypox) virüsü,1958 yılında Danimarka’daki bir laboratuvarda bulunan makak maymunları üzerindeki deri lezyonlarından çiçek (smallpox) benzeri bir virüs olarak izole edilmiştir4. İnsanlarda ise ilk vaka 1970 yılında Demokratik Kongo Cumhuriyeti’nde bir bebekte tanımlanmıştır5,6. Maymun çiçeği hastalığı, variola virüsü (çiçek hastalığına neden olan viral ajan) gibi diğer patojenik virüsleri içeren Orthopoxvirus cinsinin bir türü olup, bir DNA virüsü olan maymun çiçeği virüsünün (MPXV) neden olduğu zoonotik bir hastalıktır7,8. MPXV’nin iki türü (suş) bulunmaktadır: Orta Afrika ve Batı Afrika. Orta Afrika suşunun, Batı Afrika suşundan daha ciddi enfeksiyonlara neden olurken aynı zamanda hastalığın ölümle sonuçlanma riskini artırdığı bildirilmiştir9. MPXV’nin doğal rezervuarı halen bilinmezliğini korumaktadır; ancak insan popülasyonları için vektörün kemirgenler olduğu düşünülmektedir10. İki salgın ve üç izole vaka ile 2003 yılında Afrika kıtası dışındaki ilk oldular bildirilmiştir. Bu bildirimler 53 insan maymun çiçeği hastalığı vakasıyla sonuçlanmıştır. Ekim 2018’de Nijerya’dan İsrail’e seyahat eden bir erkek hasta raporlanmıştır. Mayıs 2019’da yine Nijerya’dan bu sefer Singapur’a seyahat eden bir hastalık vakası tespit edilmiştir. 2021 yılında da Nijerya’ya seyahat eden Birleşik Krallık’ta yaşayan bir ailenin 3 aileye birden bulaş gerçekleştirdiği vakalar gözlenmiştir11-14. MPXV enfeksiyonu için kanıtlanmış risk faktörleri arasında; Orta ve Batı Afrika’nın yoğun ormanlık ve kırsal alanlarında yaşamak, vahşi hayvan (bushmeat) eti işlemek ve hazırlamak, MPXV bulaşmış birine bakım vermek ve çiçek hastalığına karşı aşılanmamak bulunmaktadır15,16. MPXV iletiminin iki olası yolu, hayvan-insan bulaşması ve insan-insan bulaşmasıdır. Vücut sıvıları, cilt lezyonları veya enfekte hayvanların solunum damlacıkları ile doğrudan veya dolaylı olarak kontamine olmuş konaklarla temas yoluyla insandan insana bulaşma olabilmektedir; ancak insanlar arasında hastalık yayılımının sınırlı olduğu gözlenmiştir17-21. Zoonotik bulaşma olarak da bilinen hayvandan insana bulaşma için risk faktörleri; enfekte hayvanlarla karşılaşma ihtimali olan ormanlık alanlar gibi yerler ve açık havada uyumak gibi durumlar olarak tanımlanmıştır22. MPXV insidansı ile ilgili sadece hakemli dergilerde yayımlanmış 6 makalede veri bulunmaktadır. En son 2016’daki bir salgındaki insidans, hem doğrulanmış hem de doğrulanmamış vakalar için 50/10.000 olarak verilmiştir22.
Bu derlemede, MPXV’nin klinik belirtileri, moleküler mekanizmaları ve güncel tedavi yaklaşımlarının değerlendirilmesi amaçlanmaktadır.
Patofizyoloji ve Klinik Belirtiler
Orthopoxvirus türleri, çift sarmallı (ds) DNA virüsleridir ve konak hücrenin sitoplazmasında çoğalmaktadır. Konakçı sitoplazmasındaki bileşenler, virüsün genetik materyalinin replikasyonu başta olmak üzere gen ekspresyonu ve olgun viryonların montajını sağlamaktadır. Olgun viryonlar daha sonra ya hücre dışı virüsler oluşturmak için çift katmanlı bir lipid tabakası ile sarılmakta ya da hücre içinde kalmaktadır. Hücre dışına çıkan viryonlar, virüsün organizma içinde yayılabilmesi için hücreler arasında uzun mesafeler boyunca iletiminden sorumludur. Bu virüsler kendi genetik materyallerini çoğaltmada kullandıkları genleri kodlayabilmektedir; ancak viral yaşam döngüsü için konakçı proteinlere ihtiyaç duymaktadır9.
İnsan maymun çiçeği hastalığı, çiçek hastalığına benzemekle birlikte daha hafif bir klinik sunuma sahiptir. Kuluçka süresi bulaşma yoluna göre farklılık gösterse de 7- 17 gün23 ya da 5-21 gün24 arasında değişmekte ve kuluçka süresince bulaşıcı olarak tanımlanmamaktadır24. Genellikle hastalık ateş, titreme, miyalji, baş ağrısı ve lenfadenopati gibi spesifik olmayan belirtiler (semptomlar) ve ardından vezikülo-püstüler döküntü ile kendini göstermektedir25,26. Bununla birlikte erken dönemde ateşle seyreden lenfadenopatiyi takip eden birkaç gün içinde deri döküntüleri gözlenmektedir. Ek olarak, hastalarda sekonder komplikasyonlar (görme kaybı, bakteriyel enfeksiyonlar, solunum ve gastrointestinal tutulum vb.) oluşabilmektedir (Şekil 1)26,27.
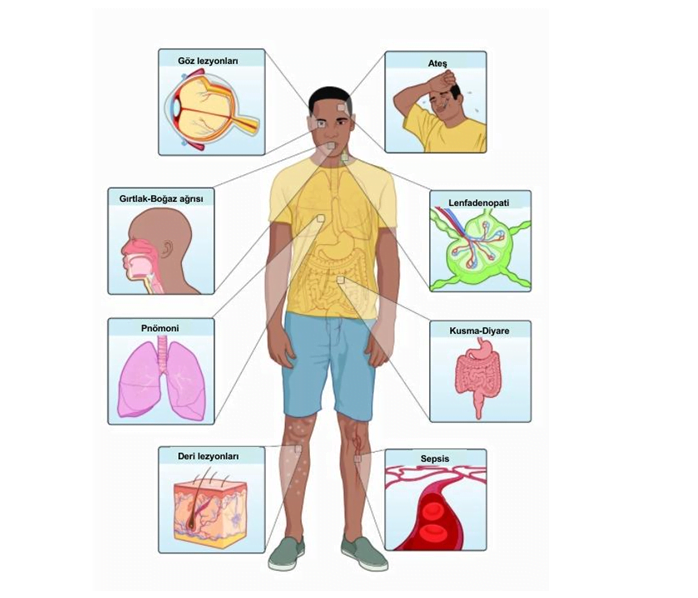
Şekil 1. Maymun çiçeği virüsü enfeksiyonunun etkilediği organların şematik gösterimi26. (Resim: Jennifer Oosthuizen, CDC İletişim Hizmetleri Bölümü).
Hastalıktan Korunma ve Tedavi Yaklaşımları
Şu anda, MPXV enfeksiyonu için klinik olarak kanıtlanmış spesifik bir tedavi bulunmamaktadır; ancak çoğu viral hastalıkta olduğu gibi, semptomatik tedavi yöntemi uygulanabilmektedir. Bununla birlikte, bir salgını önlemeye yardımcı olabilecek birtakım korunma yöntemleri bulunmaktadır. Enfekte olan kişinin karantinaya alınması, maske kullanımı, tüm lezyon kabukları kendiliğinden dökülene ve yeni bir cilt tabakası oluşana kadar bölgesel pansuman bunlar arasında sayılabilmektedir. Hali hazırda çiçek hastalığı için FDA onayı alan oral DNA polimeraz inhibitörü brincidofovir (CMX001), oral intrasellüler viral salım inhibitörü tecovirimat (ST-246) ve intravenöz vaccinia virüsü immünglobulini (VIG) ile yapılan hayvan deneylerinde maymun çiçeği virüsüne karşı da bilinmeyen etkinlikleri tanımlanmıştır28-32. Yakın zamanda çeşitli Orthopoxvirus türlerine karşı geliştirilen bir rekombinant immünoglobulinin (rVIG) etkinlik araştırmaları gerçekleştirilmiştir33. Şu anda 2019 yılında FDA tarafından onaylanan bir aşı olan Jynneos, hem çiçek hastalığı hem de insan maymun çiçeği hastalığı için ruhsatlandırılmıştır. Bir diğer aşı ise MPXV enfeksiyonları için %85 oranında koruma sağladığı bilinen ve 40 yıl önce üretimi durdurulan çiçek hastalığı aşısıdır34.
İnsan maymun çiçeği hastalığı, nadir görülen endemik bir enfeksiyöz hastalık olarak değerlendirilmiştir; ancak geçtiğimiz yıllarda ve birkaç gün öncesine kadar Afrika kıtası dışında bildirilen vaka raporları, sanılanın aksine epidemik olma yolunda ilerleyen yayılıma işaret etmektedir. Maymun çiçeği virüsü (MPXV) ölümle sonuçlanma riski yüksek ve halk sağlığı için tehlike oluşturabilecek bir patojenite olarak kabul edilmektedir. Bu nedenle, herhangi bir olası salgın için hazırlık ve mücadele faaliyetlerinin tasarlanması, uygun önlemlerin alınması, enfeksiyon durumunda kullanılabilecek terapötiklerin temini ve bunların adil dağıtımı gibi konularda küresel olarak acil planların oluşturulması gerekmektedir. Mevcut durum bir kez daha göstermiştir ki doğa insanoğlunun aleyhine çalışan bir mekanizma ile yeni patojenler, eski patojenlerin yeni dağılımları ya da doğal afetlerle dünyada sadece bizlerin olmadığını ve kendi varlığını sürdürebilmek adına bizlerle mücadeleye devam ettiğini hatırlatmaktadır.
Derleme yazılarımızda bahsedilen ilaçlar ve tedavi yöntemleri sadece makalelerden alınan bilgilere dayanmaktadır. Tıbbi bir tavsiye olarak verilmemektedir. Tanı, tedavi ve ilaç kullanımı konusunda lütfen bir uzman hekime danışınız.
Yazar: İrem Coşkuntan
Editör: Fatma Duran
Referanslar:
- Monkeypox cases reported in UK and Portugal. (n.d.-a). Retrieved May 19, 2022, from https://www.ecdc.europa.eu/en/news-events/monkeypox-cases-reported-uk-and-portugal
- Monkeypox – United Kingdom of Great Britain and Northern Ireland. (n.d.-b). Retrieved May 19, 2022, from https://www.who.int/emergencies/disease-outbreak-news/item/2022-DON381
- Massachusetts public health officials confirm case of monkeypox | Mass.gov. (n.d.-c). Retrieved May 19, 2022, from https://www.mass.gov/news/massachusetts-public-health-officials-confirm-case-of-monkeypox
- Magnus, P. von, Andersen, E. K., Petersen, K. B., & Birch‐Andersen, A. (1959). A POX-LIKE DISEASE IN CYNOMOLGUS MONKEYS. Acta Pathologica Microbiologica Scandinavica, 46(2), 156–176. https://doi.org/10.1111/J.1699-0463.1959.TB00328.X
- Breman, J. G., Kalisa-Ruti, Steniowski, M. V., Zanotto, E., Gromyko, A. I., & Arita, I. (1980). Human monkeypox, 1970-79. Bulletin of the World Health Organization, 58(2), 165. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2395797/
- Ladnyj, I. D., Ziegler, P., & Kima, E. (1972). A human infection caused by monkeypox virus in Basankusu Territory, Democratic Republic of the Congo. Bulletin of the World Health Organization, 46(5), 593. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2480792/
- Alakunle, E., Moens, U., Nchinda, G., & Okeke, M. I. (2020). Monkeypox Virus in Nigeria: Infection Biology, Epidemiology, and Evolution. Viruses, 12(11). https://doi.org/10.3390/V12111257
- Parker, S., & Buller, R. M. (2013). A review of experimental and natural infections of animals with monkeypox virus between 1958 and 2012. Http://Dx.Doi.Org/10.2217/Fvl.12.130, 8(2), 129–157. https://doi.org/10.2217/FVL.12.130
- Realegeno, S., Puschnik, A. S., Kumar, A., Goldsmith, C., Burgado, J., Sambhara, S., Olson, V. A., Carroll, D., Damon, I., Hirata, T., Kinoshita, T., Carette, J. E., & Satheshkumar, P. S. (2017). Monkeypox Virus Host Factor Screen Using Haploid Cells Identifies Essential Role of GARP Complex in Extracellular Virus Formation. Journal of Virology, 91(11). https://doi.org/10.1128/JVI.00011-17
- Falendysz, E. A., Lopera, J. G., Doty, J. B., Nakazawa, Y., Crill, C., Lorenzsonn, F., Kalemba, L. N., Ronderos, M. D., Mejia, A., Malekani, J. M., Karem, K., Carroll, D. S., Osorio, J. E., & Rocke, T. E. (2017). Characterization of Monkeypox virus infection in African rope squirrels (Funisciurus sp.). PLoS Neglected Tropical Diseases, 11(8). https://doi.org/10.1371/JOURNAL.PNTD.0005809
- Multistate Outbreak of Monkeypox— Illinois, Indiana, and Wisconsin, 2003. (2003). JAMA, 290(1), 30. https://doi.org/10.1001/JAMA.290.1.30
- Erez, N., Achdout, H., Milrot, E., Schwartz, Y., Wiener-Well, Y., Paran, N., Politi, B., Tamir, H., Israely, T., Weiss, S., Beth-Din, A., Shifman, O., Israeli, O., Yitzhaki, S., Shapira, S. C., Melamed, S., & Schwartz, E. (2019). Diagnosis of Imported Monkeypox, Israel, 2018. Emerging Infectious Diseases, 25(5), 980. https://doi.org/10.3201/EID2505.190076
- Yong, S. E. F., Ng, O. T., Ho, Z. J. M., Mak, T. M., Marimuthu, K., Vasoo, S., Yeo, T. W., Ng, Y. K., Cui, L., Ferdous, Z., Chia, P. Y., Aw, B. J. W., Manauis, C. M., Low, C. K. K., Chan, G., Peh, X., Lim, P. L., Chow, L. P. A., Chan, M., … Leo, Y. S. (2020). Imported Monkeypox, Singapore. Emerging Infectious Diseases, 26(8), 1826. https://doi.org/10.3201/EID2608.191387
- Hobson, G., Adamson, J., Adler, H., Firth, R., Gould, S., Houlihan, C., Johnson, C., Porter, D., Rampling, T., Ratcliffe, L., Russell, K., Shankar, A. G., & Wingfield, T. (2021). Family cluster of three cases of monkeypox imported from Nigeria to the United Kingdom, May 2021. Eurosurveillance, 26(32), 1. https://doi.org/10.2807/1560-7917.ES.2021.26.32.2100745
- Rimoin, A. W., Mulembakani, P. M., Johnston, S. C., Lloyd Smith, J. O., Kisalu, N. K., Kinkela, T. L., Blumberg, S., Thomassen, H. A., Pike, B. L., Fair, J. N., Wolfe, N. D., Shongo, R. L., Graham, B. S., Formenty, P., Okitolonda, E., Hensley, L. E., Meyer, H., Wright, L. L., & Muyembe, J. J. (2010). Major increase in human monkeypox incidence 30 years after smallpox vaccination campaigns cease in the Democratic Republic of Congo. Proceedings of the National Academy of Sciences of the United States of America, 107(37), 16262–16267. https://doi.org/10.1073/pnas.1005769107
- Petersen, B. W., Kabamba, J., McCollum, A. M., Lushima, R. S., Wemakoy, E. O., Muyembe Tamfum, J. J., Nguete, B., Hughes, C. M., Monroe, B. P., & Reynolds, M. G. (2019). Vaccinating against monkeypox in the Democratic Republic of the Congo. Antiviral Research, 162, 171. https://doi.org/10.1016/J.ANTIVIRAL.2018.11.004
- Petersen, E., Kantele, A., Koopmans, M., Asogun, D., Yinka-Ogunleye, A., Ihekweazu, C., & Zumla, A. (2019). Human Monkeypox: Epidemiologic and Clinical Characteristics, Diagnosis, and Prevention. Infectious Disease Clinics of North America, 33(4), 1027–1043. https://doi.org/10.1016/J.IDC.2019.03.001
- Brown, K., & Leggat, P. A. (2016). Human Monkeypox: Current State of Knowledge and Implications for the Future. Tropical Medicine and Infectious Disease, 1(1). https://doi.org/10.3390/TROPICALMED1010008
- Nasir, I. A., Dangana, A., Ojeamiren, I., & Emeribe, A. U. (2018). Reminiscing the recent incidence of monkeypox in Nigeria: Its ecologic-epidemiology and literature review. Port Harcourt Medical Journal, 12(1), 1. https://doi.org/10.4103/PHMJ.PHMJ_47_17
- Kabuga, A. I., & El Zowalaty, M. E. (2019). A review of the monkeypox virus and a recent outbreak of skin rash disease in Nigeria. Journal of Medical Virology, 91(4), 533–540. https://doi.org/10.1002/JMV.25348
- Reynolds, M. G., Doty, J. B., McCollum, A. M., Olson, V. A., & Nakazawa, Y. (2019). Monkeypox re-emergence in Africa: a call to expand the concept and practice of One Health. Expert Review of Anti-Infective Therapy, 17(2), 129. https://doi.org/10.1080/14787210.2019.1567330
- Bunge, E. M., Hoet, B., Chen, L., Lienert, F., Weidenthaler, H., Baer, L. R., & Steffen, R. (2022). The changing epidemiology of human monkeypox-A potential threat? A systematic review. PLoS neglected tropical diseases, 16(2), e0010141. https://doi.org/10.1371/journal.pntd.0010141
- Angelo, K. M., Petersen, B. W., Hamer, D. H., Schwartz, E., & Brunette, G. (2019). Monkeypox transmission among international travellers—serious monkey business? Journal of Travel Medicine, 26(5). https://doi.org/10.1093/JTM/TAZ002
- Grant, R., Nguyen, L. B. L., & Breban, R. (2020). Modelling human-to-human transmission of monkeypox. Bulletin of the World Health Organization, 98(9), 638. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7463189/
- Huhn, G. D., Bauer, A. M., Yorita, K., Graham, M. B., Sejvar, J., Likos, A., Damon, I. K., Reynolds, M. G., & Kuehnert, M. J. (2005). Clinical Characteristics of Human Monkeypox, and Risk Factors for Severe Disease. Clinical Infectious Diseases, 41(12), 1742–1751. https://doi.org/10.1086/498115
- Reynolds, M. G., McCollum, A. M., Nguete, B., Lushima, R. S., & Petersen, B. W. (2017). Improving the Care and Treatment of Monkeypox Patients in Low-Resource Settings: Applying Evidence from Contemporary Biomedical and Smallpox Biodefense Research. Viruses, 9(12). https://doi.org/10.3390/V9120380
- Sklenovská, N., & Van Ranst, M. (2018). Emergence of Monkeypox as the Most Important Orthopoxvirus Infection in Humans. Frontiers in Public Health, 6. https://doi.org/10.3389/FPUBH.2018.00241
- Wilson, M. E., Hughes, J. M., McCollum, A. M., & Damon, I. K. (2014). Human Monkeypox. Clinical Infectious Diseases, 58(2), 260–267. https://doi.org/10.1093/CID/CIT703
- Hutson, C. L., Kondas, A. V., Mauldin, M. R., Doty, J. B., Grossi, I. M., Morgan, C. N., Ostergaard, S. D., Hughes, C. M., Nakazawa, Y., Kling, C., Martin, B. E., Ellison, J. A., Carroll, D. D., Gallardo-Romero, N. F., & Olson, V. A. (2021). Pharmacokinetics and Efficacy of a Potential Smallpox Therapeutic, Brincidofovir, in a Lethal Monkeypox Virus Animal Model. MSphere, 6(1). https://doi.org/10.1128/MSPHERE.00927-20
- Russo, A. T., Berhanu, A., Bigger, C. B., Prigge, J., Silvera, P. M., Grosenbach, D. W., & Hruby, D. (2020). Co-administration of Tecovirimat and ACAM2000TM in Non-human Primates: Effect of Tecovirimat Treatment on ACAM2000 Immunogenicity and Efficacy Versus Lethal Monkeypox Virus Challenge. Vaccine, 38(3), 644. https://doi.org/10.1016/J.VACCINE.2019.10.049
- Jordan, R., Goff, A., Frimm, A., Corrado, M. L., Hensley, L. E., Byrd, C. M., Mucker, E., Shamblin, J., Bolken, T. C., Wlazlowski, C., Johnson, W., Chapman, J., Twenhafel, N., Tyavanagimatt, S., Amantana, A., Chinsangaram, J., Hruby, D. E., & Huggins, J. (2009). ST-246 Antiviral Efficacy in a Nonhuman Primate Monkeypox Model: Determination of the Minimal Effective Dose and Human Dose Justification. Antimicrobial Agents and Chemotherapy, 53(5), 1817. https://doi.org/10.1128/AAC.01596-08
- Gilchuk, I., Gilchuk, P., Sapparapu, G., Lampley, R., Singh, V., Kose, N., Blum, D. L., Hughes, L. J., Satheshkumar, P. S., Townsend, M. B., Kondas, A. V., Reed, Z., Weiner, Z., Olson, V. A., Hammarlund, E., Raue, H. P., Slifka, M. K., Slaughter, J. C., Graham, B. S., … Crowe, J. E. (2016). Cross-Neutralizing and Protective Human Antibody Specificities to Poxvirus Infections. Cell, 167(3), 684. https://doi.org/10.1016/J.CELL.2016.09.049
- Parker, S., D’Angelo, J., Buller, R. M., Smee, D. F., Lantto, J., Nielsen, H., Jensen, A., Prichard, M., & George, S. L. (2021). A human recombinant analogue to plasma-derived vaccinia immunoglobulin prophylactically and therapeutically protects against lethal orthopoxvirus challenge. Antiviral Research, 195, 105179. https://doi.org/10.1016/J.ANTIVIRAL.2021.105179
- Volkmann, A., Williamson, A. L., Weidenthaler, H., Meyer, T. P. H., Robertson, J. S., Excler, J. L., Condit, R. C., Evans, E., Smith, E. R., Kim, D., & Chen, R. T. (2021). The Brighton Collaboration standardized template for collection of key information for risk/benefit assessment of a Modified Vaccinia Ankara (MVA) vaccine platform. Vaccine, 39(22), 3067. https://doi.org/10.1016/J.VACCINE.2020.08.050

Biyolog, Radyoterapi teknikeri. İstanbul Üniversitesi Aziz Sancar Deneysel Tıp Araştırma Enstitüsü / MSc. Genetik, doktora öğrencisi, İ.Ü. Bilgisayar Programcılığı öğrencisi.
İlgi alanları; inflamasyon genetiği, kanser genetiği, hücre biyolojisi, immünoloji, biyoinformatik, biyoistatistik, radyasyon onkolojisi.

